Agrégation/Capes > Capes : montages de chimie > capes-chimie-montage-1-alcools
CAPES-Montage chimie n°1 :
Expériences illustrant les propriétés chimiques des alcools
Pour rechercher un mot dans la page, utilisez la fonction de votre navigateur
(Ctrl + F)
Introduction :
La formule générale des alcools peut être représenté par C-OH, le carbone étant lié à 3 groupements.
On a un alcool primaire si 1 des groupements lié au C est un groupe alkyl R, les autres groupes étant des simples atomes d'hydrogène.
L'alcool est secondaire si on a 2 groupes alkyl R (qui peuvent être différents) et un hydrogène.
L'alcool est donc tertiaire si on a 3 groupes alkyl R (qui peuvent être différents) lié au C.
Réactivité du groupe hydroxyle -OH :
Propriétés acido-basiques :
Expérience :
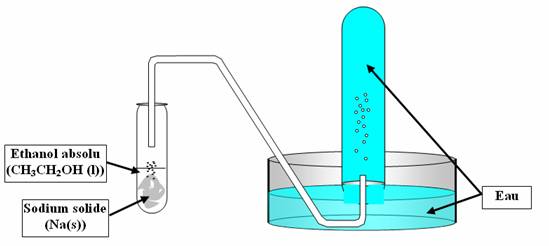
- Mettre le sodium sur papier filtre, enlever la paraffine dans laquelle il est conservé.
- On purge l'air dans le tube à essai retourné, qui est destiné à récupérer le gaz dégagé par la réaction.
- On mettra ensuite le matériel utilisé dans l'éthanol pour éviter que le sodium ne rentre en contact avec de l'eau par exemple.
Caractérisation des produits de la réaction :
- On peut présenter le tube à essai à une flamme de bec Bunsen ou d'allumette, on obtient une détonation, ce qui caractérise le dihydrogène H2.
- On peut nettoyer un fil de platine et le plonger dans la solution du tube à essais où il s'est déroulé la réaction. On le présente ensuite à la flamme : la flamme devient jaune, preuve de la présence de l'ion sodium Na+. (voir la vidéo ici)
- On peut verser de la phénolphtaléine dans la solution contenue dans le tube à essais de la réaction : on obtient une couleur violette synonyme de solution basique : présence de CH3CH2O-.
Il faudra faire un témoin avec un tube à essais contenant de l'éthanol et de la phénolphtaléine, qui présente aucune coloration.
Equation de la réaction :
CH3CH2OH(l) + Na(s)  1/2 H2(g) + Na+(aq) + CH3CH2O-(aq)
1/2 H2(g) + Na+(aq) + CH3CH2O-(aq)
Estérification :
Expérience :
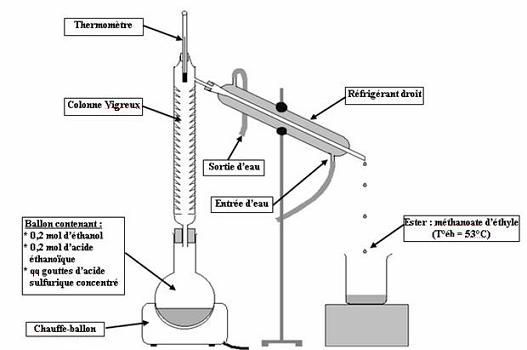
- On distille l'ester à l'aide de la colonne Vigreux et du réfrigérant droit afin d'éviter l'hydrolyse de l'ester (T°éb = 53°C).
- L'équation de la réaction est donc :
HCOOH(l) + CH3CH2OH(l) HCOOCH2CH3 + H2O(l)
HCOOCH2CH3 + H2O(l)
Calcul du rendement :
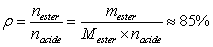
Le rendement est plutôt bon grâce à la distillation de l'ester, en l'éliminant du milieu réactionnel, on fait diminuer le quotient de réaction Qr qui s'éloigne alors de K, on favorise un bon rendement en déplaçant l'équilibre.
Test hydroxamique de caractérisation des esters :
A réaliser avec des gants
- 1 mL de chlorhydrate d'hydroxylamine
- + 1 mL de d'ester (pour le témoin) ou du liquide à tester
- + 1 mL de soude (au 1/3)
- + Chauffage à ébullition avec un peu de pierre ponce
- + refroidissement sous l'eau du robinet
- + acidification à l'acide chlorhydrique (au 1/3) : contrôle au papier pH
- + quelques gouttes de chlorure de fer III
Test positif = coloration lie de vin
Rupture de la liaison C-OH :
Substitution nucléophile :
Expérience :
A réaliser avec des gants et des lunettes
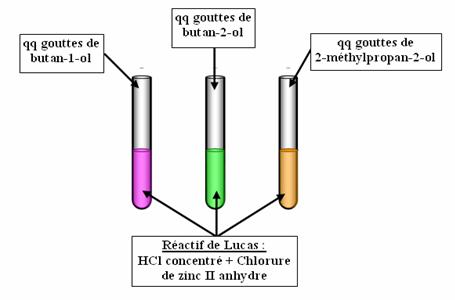
Les couleurs des tubes à essais ont juste pour but de montrer que les trois alcools sont différents.
Observations :
- Avec l'alcool tertaire (2-méthylpropan-2-ol), on observe un trouble.
- Avec l'alcool secondaire (Butan-2-ol), on observe un léger trouble.
- Avec l'alcool primaire (butan-1-ol), on n'observe rien.
Le trouble observé est du aux dérivés chlorés, insolubles dans l'eau.
Rôle du chlorure de zinc anhydre :
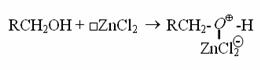
Il s'agit d'un catalyseur, avec lui la formation du carbocation est plus aisée. On le prend anhydre pour éviter toute réaction avec l'eau.
Interprétation :
On observe que le trouble, donc la formation du dérivé chloré, diminue lorsque l'encombrement de l'alcool diminue (on n'observe aucun trouble avec l'alcool primaire) : La sustitution est donc de type SN1.
Déshydratation catalytique :
Expérience :
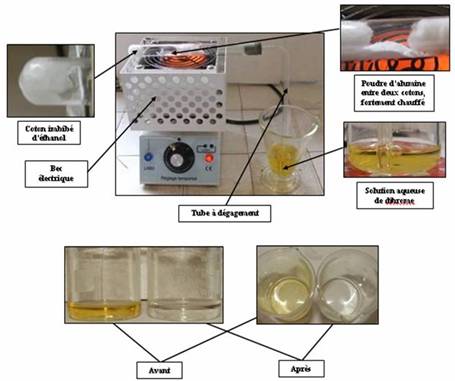
On chauffe non pas l'éthanol, mais l'alumine.
Observation :
L'eau de brome, jaune au départ, est devenu incolore.
Interprétation :
Nous avons produit un alcène en déshydratant catalytiquement l'éthanol.
Equation de la réaction :
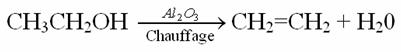
Rôle de l'alumine Al2O3 :
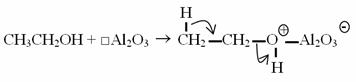
Remarque :
On peut former un éther :
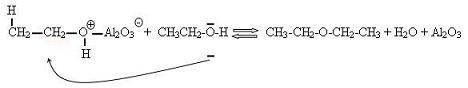
Oxydations :
Oxydation ménagée en phase gazeuse :
Expérience de la lampe sans flamme :
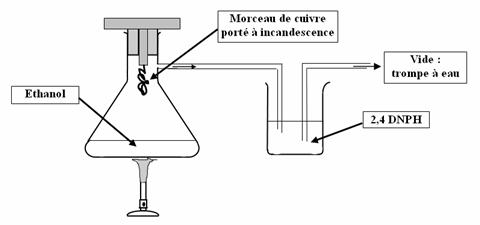
Observation :
La 2,4 DNPH se trouble après quelques instants.
Interprétation :
La 2,4 DNPH précipite lorsqu'on la met d'un aldéhyde ou d'une cétone. Or, nous sommes partis de l'éthanol, alcool primaire, on obtient donc un aldéhyde.
Equation de la réaction :
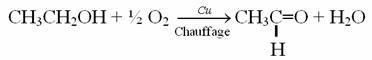
Oxydation ménagée en phase aqueuse :
Expérience :
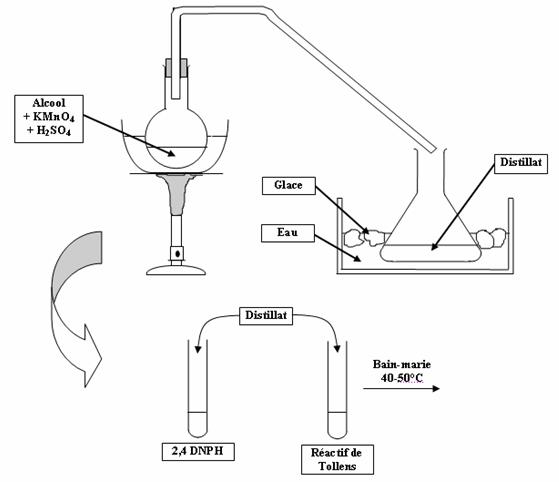
Observations :
- Remarque : On ne peut pas effectuer cette expérience avec un alcool tertiaire, dont l'oxydation ménagée n'est pas possible dans ce conditions.
- Dés l'ajout de l'alcool dans le ballon, l'oxydation commence et le permanganate se décolore (passage de MnO4- à Mn2+).
- On effectue la distillation des vapeurs produites, grâce au bain d'eau glacée.
- Selon la classe de l'alcool utilisé, les résultats des tests caractéristiques dans les tubes à essais sont différents :
* Le test à la 2,4 DNPH est positif que l'alcool de départ soit primaire et secondaire : on obtient un précipité orange.
* Le test au réactif de Tollens est positif avec l'alcool primaire uniquement : après le bain-marie, on obtient un miroir d'argent.
Interprétation :
- Si le test à la 2,4 DNPH est positif ainsi que celui au réactif de Tollens, l'oxydation a formé un aldéhyde et nous sommes partis d'un alcool primaire.
- Si le test à la 2,4 DNPH est positif mais pas celui au réactif de Tollens, l'oxydation a formé une cétone et donc nous sommes partis d'un alcool secondaire.
Conclusion :
Les alcools sont utilisés dans la chimie des arômes et des parfums (dans la branche alimentaire notamment).
exemple : alcool benzylique = odeur de jasmin.