Licence 1 > Thermodynamique > Cours 1 : grandeurs thermodynamiques et équations d'état
T2 : Transformations - premier principe
Introduction
La thermodynamique explore les transformations énergétiques dans les systèmes physiques. Dans ce chapitre après avoir abordé de façon générale la notion de transformation et exploré les différents adjectifs qu'on pourra associer à ce mot, nous verrons les processus qui permettent d'échanger de l'énergie entre notamment un système thermodynamique et l'extérieur : ce sont le travail et la chaleur. Pour cette dernière, on devra évoquer une de ses caractéristiques, la capacité calorifique. Pour ce qui est du travail, on s'intéressera au travail des forces de pression.
Enfin, le lien entre travail et chaleur donne naissance au premier principe de la thermodynamique, très utilisé dans la résolution des exercices quels qu'ils soient. On terminera par étudier la détente de Joule, une des nombreuses contribution de ce scientifique, ce qui permettra d'énoncé la première loi de Joule.
Transformations
Notion de transformation
Soit un corps dans un état d’équilibre appelé état 0 défini par $p_0$, $T_0$, $V_0$, on peut lui faire subir une transformation thermodynamique pour l’amener dans un état d’équilibre appelé état 1 défini par $p_1$, $T_1$, $V_1$.
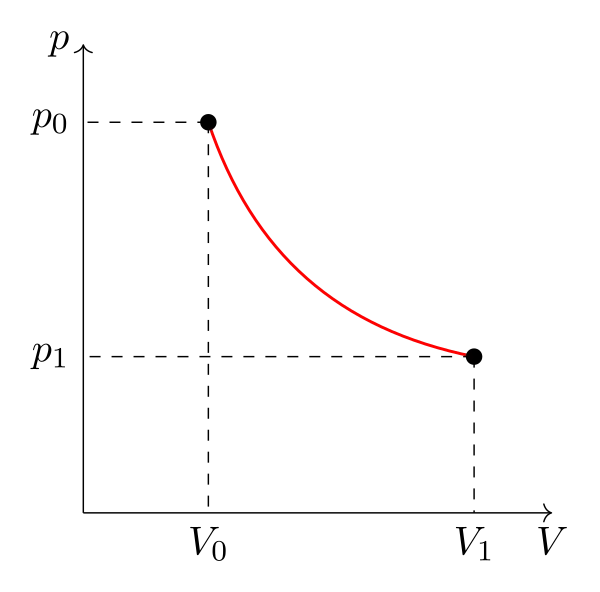
Il est possible de représenter ces états dans un diagramme thermodynamique comme le diagramme de Clapeyron (pression=f(volume massique)), le diagramme de Watt (pression=f(volume)), le diagramme des frigoristes (pression=f(enthalpie)), etc.
Transformation quasi-statique
Si, pour aller d’un état d’équilibre 0 à un état d’équilibre 1, le système passe par une succession d’état eux-même états d’équilibres, alors la transformation est dite quasi-statique.
Exemples :
- On pose une masse de 1 kg sur le piston d’une enceinte enfermant un gaz, la transformation est non quasi-statique. De même si on réalise un chauffage brutal d’une enceinte.
- Si on pose petit à petit des masses de 1 g sur le piston en attendant à chaque fois l’équilibre thermodynamique jusqu’à une masse de 1 kg alors la transformation peut être qualifiée de quasi-statique. Le chauffage lent d’une enceinte, de degré en degré en attendant à chaque fois que l’équilibre thermodynamique soit atteint est quasi-statique.
Transformation réversible
Si en plus, pour une transformation quasi-statique, à chaque étape le système est en équilibre thermodynamique avec l’extérieur, alors la transformation est qualifiée de réversible.
Remarque : une transformation peut donc être quasi-statique sans être réversible mais si elle est réversible alors elle est nécessairement quasi-statique.
Des adjectifs pour des transformations particulières
- Transformation isobare : la pression du système est constante tout au long de la transformation;
- Transformation monobare : la pression du système est la même à l’état initial et à l’état final de la transformation, généralement car il est en contact avec l’extérieur dont la pression est constante. La pression du système peut varier au cours de la transformation.
- Transformation isotherme : la température du gaz reste constante au cours de la transformation;
- Transformation monotherme : la température du gaz est la même dans l’état initial et l’état final de la transformation;
- Transformation isochore : le gaz conserve le même volume au cours de la transformation;
- Transformation monochore : le volume du gaz est identique au début et à la fin de la transformation.
Coefficients thermoélastiques
- Coefficient de dilatation isobare : Ce coefficient décrit la façon dont le volume d’un gaz change lorsqu’on le chauffe à pression constante : \begin{equation}\alpha = \dfrac{1}{V}\,\left(\dfrac{\partial V}{\partial T}\right)_p\end{equation}
Remarque :
pour un gaz parfait, $V = \dfrac{n\,R\,T}{p} \Longrightarrow
\dfrac{\partial V}{\partial T} = \dfrac{n\,R}{p} \Longrightarrow \alpha
= \dfrac{1}{V}\,\dfrac{n\,R}{p} = \dfrac{1}{T}$
- Coefficient de compression isotherme : Ce coefficient décrit la
façon dont le volume d’un gaz change lorsqu’on le comprime à
température constante : \begin{equation}\chi_T =
-\dfrac{1}{V}\,\left(\dfrac{\partial V}{\partial p}\right)_T\end{equation}
Coefficients thermoélastiques
Coefficient de dilatation isobare : \begin{equation}\alpha = \dfrac{1}{V}\,\left(\dfrac{\partial V}{\partial T}\right)_p\end{equation}
Coefficient de compression isotherme : \begin{equation}\chi_T = -\dfrac{1}{V}\,\left(\dfrac{\partial V}{\partial p}\right)_T\end{equation}
Chaleur et travail
Soit une casserole d’eau que l’on chauffe à l’aide d’une bougie, sa température augmente. Il s’avère que si on chauffe deux fois plus (avec deux bougies), alors la température s’élève deux fois plus. Cette expérience peut être interprétée par le fait que le système de chauffe a transmis de la chaleur à l’eau. On peut alors écrire que la quantité de chaleur transférée est proportionnelle à la température.
De la même manière, si on diminue la taille du système de moitié, une bougie suffit à élever la température deux fois plus que la situation avec système entier et une bougie. On peut donc écrire que la quantité de chaleur est inversement proportionnelle à la masse du système.
Enfin si on change de système, la relation entre quantité de chaleur et augmentation de la température change.
Capacités calorifiques
Dans de nombreuses situations, on peut donc écrire la proportionnalité entre la quantité de chaleur et la température \begin{equation}\delta Q = C\,\mathrm{d}T\end{equation} avec $C$ la capacité calorifique du système.
Si on considère que la capacité calorifique est indépendante de la température (ce qui est assez vrai) alors : \begin{equation}Q = C\,\Delta T\end{equation} On a donc une capacité calorique exprimée en $\mathrm{J.K^{-1}}$.
Remarque : différence pour une grandeur $G$ entre $\delta G$ et $\mathrm{d}G$
- On note une grandeur infinitésimal $\delta G$ lorsqu’il ne s’agit pas d’une variation d’une grandeur d’état, que ce n’est pas une différentielle totale exacte, que son intégration entre deux états donnés dépend du chemin suivi.
- Si la grandeur est notée $\mathrm{d}G$ alors il s’agit d’une différentielle totale exacte, son intégration entre deux états ne dépend que des caractéristiques de l’état initial et de l’état final et donc ne dépend pas du chemin suivi entre ces deux états.
La capacité calorifique peut être molaire ou massique, alors on définit :
- Capacité calorifique molaire $c$ : \begin{equation}c = \dfrac{C}{n} \quad \text{avec $n$ la quantité de matière en mole (mol)}\end{equation} Cette capacité calorifique molaire s’exprime en $\mathrm{J.mol^{-1}.K^{-1}}$
- Capacité calorifique massique $c_m$ : \begin{equation}c_m = \dfrac{C}{m} \quad \text{avec $m$ la masse en kilogramme (kg)}\end{equation} Cette capacité calorifique massique s’exprime en $\mathrm{J.kg^{-1}.K^{-1}}$
Unité de la quantité de chaleur $Q$
Nous verrons par la suite l’équivalence entre travail et chaleur et ainsi que la chaleur est une quantité d’énergie qui s’exprime en Joule (J).
Une autre unité existe, issue de l’histoire des sciences et de la supposée existence du calorique, fluide qui passait d’un corps à un autre pour en changer sa température. La calorie est donc venue de cette histoire et on définit une calorie comme étant la quantité de chaleur à fournir à 1 g d’eau pour augmenter sa température d’1 sous pression atmosphérique. On admet que \begin{equation}1\,\mathrm{calorie} = 4,18\,\mathrm{J}\end{equation}
Signe des quantités d’énergie
Par convention, une quantité d’énergie reçue par un système est comptée positivement, une quantité d’énergie fournie à l’extérieur par le système est comptée négativement.
Capacité calorifique à pression constante ou volume constant
En thermodynamique, on effectue souvent des transformations :
- à pression constante, on définit alors la capacité calorifique à pression constante, que l’on note $C_p$;
- à volume constante, on définit alors la capacité calorifique à volume constant, que l’on note $C_V$;
Imaginons l’expérience où on réalise le chauffage d’une casserole d’eau en lui apportant une certaine quantité de chaleur. On réalise cette expérience :
- dans un premier cas, avec un couvercle sur la casserole, donc à volume constant;
- dans un deuxième cas, sans couvercle, donc en contact avec l’atmosphère, soit à pression constante.


L’élévation de température du système sera plus importante dans le premier cas: en effet pour une même quantité de chaleur apportée, celle-ci va servir :
- uniquement à augmenter la température du système dans le premier cas,
- alors que dans le deuxième, une certaine quantité de chaleur va servir à l’expansion du système, il faut donc pour cela que le système fournisse de l’énergie pour "repousser" l’atmosphère.
On peut écrire pour ces deux expériences : \begin{equation}\delta Q = C_V\,\mathrm{d}T = C_p\,\mathrm{d}T'\end{equation} Or comme nous l’avons expliqué, $\mathrm{d}T > \mathrm{d}T'$, donc $C_V < C_p$.
Mesure de capacités calorifiques : calorimétrie
La calorimétrie est le domaine de la thermodynamique qui s’intéresse, entre autres, à la mesure de capacité calorifique de corps.
Exemple : on peut réaliser facilement une expérience visant à la mesure de la capacité calorifique d’un métal : dans un calorimètre, enceinte considérée comme adiabatique (pas d’échange de chaleur avec l’extérieur), on introduit :
- une certaine masse $m$ d’eau de capacité calorifique massique $c_{\mathrm{e}}$ à une température $T_1$ ;
- un bloc de métal de masse $M$ de capacité calorifique massique $c_\mathrm{M}$ que l’on a préalablement chauffé à $T_M = 100^\circ C$ en le plongeant suffisamment longtemps dans une casserole d’eau bouillante ;
- on note que le calorimètre possède une masse équivalente en eau $\mu$ : en effet, ne connaissant pas les matériaux qui le constituent, on considère que le calorimètre se comporte comme une certaine masse d’eau, appelée masse équivalente en eau du calorimètre ;
- on note $T_f$ la température du système une fois l’équilibre atteint.
Notons $Q_1$ la quantité de chaleur reçue par l’eau et le calorimètre : \begin{equation}Q_1 = (m+\mu)\,c_\mathrm{e}\,(T_f - T_1)\end{equation} Notons $Q_2$ la quantité de chaleur fournie par le métal : \begin{equation}Q_1 = M\,c_\mathrm{M}\,(T_f - T_M)\end{equation} L’enceinte (le calorimètre) étant adiabatique : \begin{equation}Q_1 + Q_2 = 0 \Longrightarrow \boxed{C_\mathrm{M} = \dfrac{-(m+\mu)\,c_e\,(T_f-T_1)}{M\,(T_f-T_M)}}\end{equation}
Remarque : Les expériences calorimétriques se faisant à pression constante (pression de l’atmosphère), calculer des quantités des chaleurs est équivalent à calculer des variations d’enthalpie. En cas de réaction chimique dans le calorimètre, on préfèrera utiliser les variations d’enthalpies plutôt que les quantités de chaleur et ainsi parler de variation d’enthalpie de réaction.
Notion de thermostat
Un thermostat est un système qui permet de conserver la température constante. Par exemple pour maintenir la température à 0°C, on peut utiliser un mélange eau+glace, ce mélange constitue le thermostat.
Travail
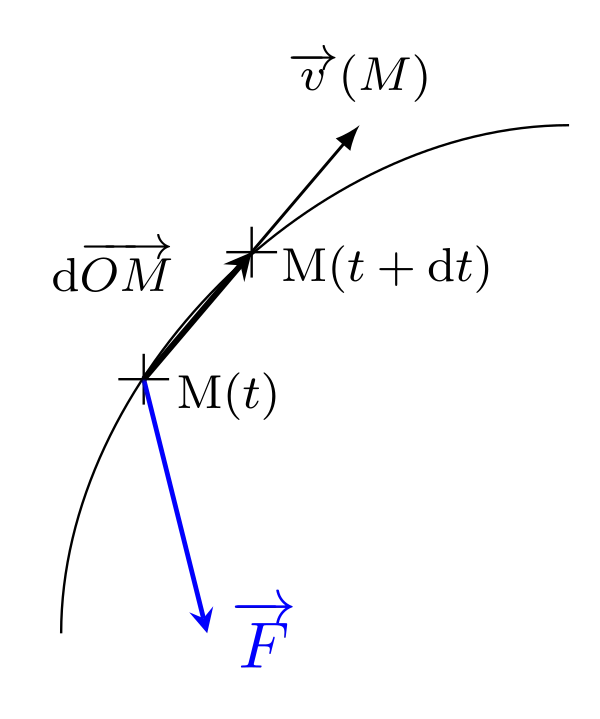
On connaît l’expression du travail mécanique, lorsqu’un corps se déplace et subit une force $\overrightarrow{F}$, on peut écrire :
\begin{equation}\delta W = \overrightarrow{F}\cdot \mathrm{d}\overrightarrow{OM} = \overrightarrow{F} \cdot \mathrm{d}\overrightarrow{\ell}\end{equation}
En thermodynamique, on s’intéresse très souvent aux forces de pression, imaginons la situation suivante :

Un gaz est contenu dans une enceinte munie d’un piston. Celui-ci est libre de se déplacer. La force que subit le gaz est la force exercée par la pression extérieure sur le piston. Soit : \begin{equation}F_\mathrm{ext} = p_\mathrm{ext} \times S\end{equation} où $S$ est la surface du piston.
On peut calculer le travail subit par le gaz pour un déplacement $\mathrm{d}\overrightarrow{\ell}$ du piston, qui est le travail de la force de pression extérieure sur le piston: \begin{equation}\delta W = \overrightarrow{F}_\mathrm{ext}\cdot \mathrm{d}\overrightarrow{\ell} = p_\mathrm{ext} \times S \,\mathrm{d}{\ell}\end{equation} puisque la force de pression et le déplacement élémentaire sont dans le même sens et la même direction. Or on reconnaît le produit $S \times \mathrm{d}\ell$ qui est la variation de volume du gaz de l’enceinte, et cette variation état négative : \begin{equation}\delta W = - p_\mathrm{ext}\,\mathrm{d}V\end{equation}
Si on est dans le cas d’une transformation quasi-statique c’est à dire que la transformation est par exemple suffisamment lente pour qu’à chaque instant il y ait équilibre thermodynamique entre l’extérieur et le gaz de l’enceinte, alors \begin{equation}\delta W = - p\,\mathrm{d}V\end{equation}
Travail des forces de pression \begin{equation*}\delta W = - p_\mathrm{ext}\,\mathrm{d}V\end{equation*} Si la transformation est quasi-statique : \begin{equation*}\delta W = - p\,\mathrm{d}V\end{equation*}
Ce travail élémentaire intégré entre deux états thermodynamiques peut se retrouver graphiquement dans un diagramme classique ($p$,$V$). En effet, il s’agit alors de l’aire sous la courbe :
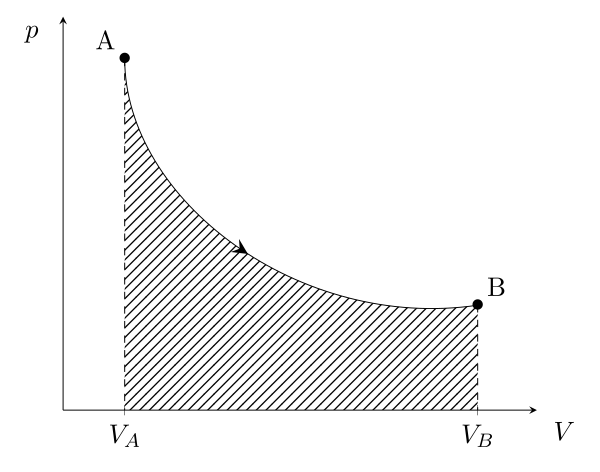
Dans ce premier cas, le volume du système grandi, c’est comme si celui-ci poussait l’atmosphère pour agrandir son volume donc le système fournit du travail \begin{equation}W_{A \to B} = -\int_A^B p\,\mathrm{d}V < 0\end{equation}
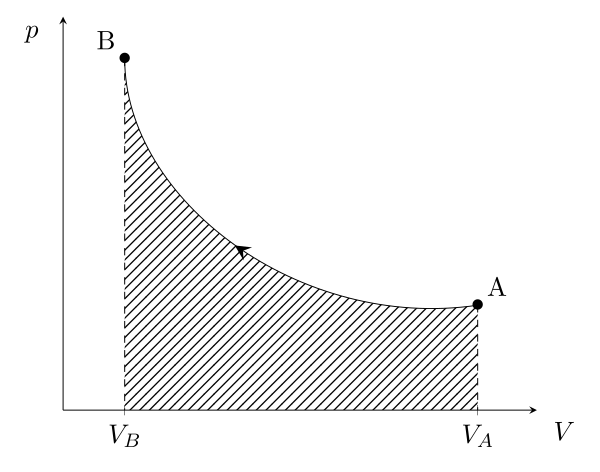
Dans ce deuxième cas, il y a diminution du volume, le système reçoit du travail \begin{equation}W_{A \to B} = -\int_A^B p\,\mathrm{d}V > 0\end{equation}
Premier principe de la thermodynamique
Equivalence entre travail et chaleur
Historiquement, ce sont les expériences de Joule qui ont montrées cette équivalence, il avait imaginé un dispositif ou le travail du à la chute d’un poids actionnait la rotation d’une hélice plongée dans un récipient d’eau : le frottement de celle-ci produisait de la chaleur. Il montre ainsi que le travail du poids est proportionnel à l’augmentation de température du liquide.
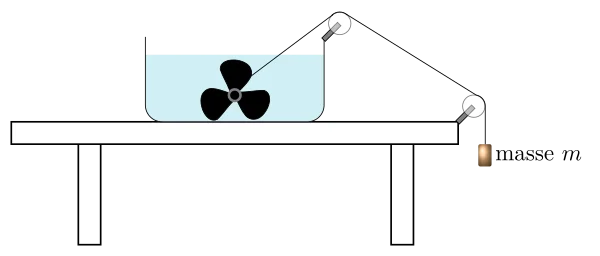
Sachant qu’avec l’expérience de la casserole d’eau chauffée par une bougie, on a vu précédemment que l’augmentation de température est proportionnelle à la chaleur apportée, alors travail et chaleur sont proportionnels, donc équivalent.
Notation : travail et chaleur ne sont pas des fonctions d’état
Nous avons vu précédemment que la quantité de chaleur et le travail élémentaire se notaient avec un $\delta$ à la place du $\mathrm{d}$ pour indiquer que ceux-ci dépendent du chemin suivi entre deux états, et pas seulement des caractéristiques de l’état initial et de l’état final de la transformation.
Ainsi, le transfert thermique et le travail ne sont pas des fonctions d’état.
Enoncé du premier principe de la thermodynamique
Première principe de la thermodynamique Pour toute transformation entre un état initial et un état final, la somme du transfert thermique et du travail ne dépend que des caractéristiques de l’état initial et de l’état final. On peut alors associer une nouvelle grandeur associée à ces états initial et final pour écrire que \begin{equation}\boxed{Q + W = \Delta U_{A\to B}}\end{equation} On appelle $U$ l’énergie interne du système qui subit la transformation. Cette énergie interne est donc pas définition une fonction d’état.
Pour une transformation élémentaire, on a \begin{equation}\delta Q + \delta W = \mathrm{d}U\end{equation}
Interprétation microscopique de l’énergie interne
Pour donner du sens à cette nouvelle grandeur physique appelée énergie interne, on peut en donner une signification microscopique : Soit un gaz parfait (pas d’interaction entre les molécules) comportant $N$ molécules, alors cette énergie est simplement la somme des énergies cinétiques de ces $N$ molécules \begin{equation}\boxed{U = \sum_{i=1}^N \dfrac{1}{2}\,m\,v_i^2}\end{equation}
Remarque : nous verrons plus loin dans ce cours de thermodynamique que les vitesses des molécules sont très diverses et qu’il convient d’introduire le concept de vitesse quadratique moyenne des molécules. On remplacera ainsi $\sum_{i=1}^{N} ... v_i^2$ dans l’expression de $U$.
Détente de Joule, première loi de Joule
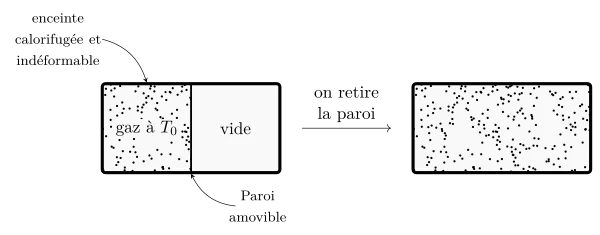
- L’enceinte étant calorifugée, la quantité de chaleur échangée par le gaz est nulle : $Q =0$ ;
- l’enceinte étant indéformable, la quantité de travail est nul : $W=0$ ;
- on en déduit que lors de cette détente: $\Delta U = 0$.
De plus, cette expérience réalisée avec un gaz parfait se fait sans changement de température : en effet, la température est liée à la vitesse des particules du gaz, et il n’y a aucune raison que les vitesses soient différentes du fait qu’il y ait plus d’espace disponible pour le gaz. Par contre la pression est modifiée : moins de chocs sur les parois car plus de volume disponible pour les molécule. Le volume change également puisqu’il est doublé.
Première loi de Joule On peut en déduire la 1ère loi de Joule: l’énergie interne d’un gaz parfait ne dépend que de la température.
En se basant sur une interprétation microscopique, pour un gaz parfait, on a: \begin{equation}\boxed{\mathrm{d}U = C_V\,\mathrm{d}T}\end{equation}
Enthalpie
Expériences
On réalise simultanément les deux expériences suivantes, en apportant la même quantité de chaleur $\delta Q$ aux deux enceintes:

On mesure l’augmentation de température dans les deux cas: la température va davantage augmenter dans le premier cas. En effet, calculons la variation d’énergie interne dans les deux cas:
- Premier cas: \begin{equation}\mathrm{d}U = \delta W + \delta Q = \delta Q \quad \text{car l'enceinte est indéformable}\end{equation}
- Deuxième cas: \begin{equation}\mathrm{d}U = \delta W + \delta Q = \delta Q - p\,\mathrm{d}V < \delta Q\end{equation}
En effet, comme $\mathrm{d}U = C_V\,\mathrm{d}T$ pour un gaz parfait, alors si $\mathrm{d}U_1 > \mathrm{d}U_2$ alors $\mathrm{d}T_1 > \mathrm{d}T_2$.
Ce résultat peut s’expliquer aisément si on regarde les conditions de la transformation dans les deux cas. Dans le deuxième cas, l’apport thermique permet à la fois d’augmenter la température du gaz de l’enceinte mais aussi d’augmenter le volume de celui-ci, le piston est poussé vers le haut, pousse l’atmosphère, donc fournit du travail. Tout l’apport énergétique ne sert pas uniquement à augmenter la température.
Définition
Fonction enthalpie
Dans le cas où seules les
forces de pression travaillent, on définit une nouvelle
fonction d’état \begin{equation}H = U + P\,V\end{equation}
appelée enthalpie, homogène à une énergie, donc qui s’exprime en Joule
(J).
On a donc \begin{equation}\mathrm{d}H = \mathrm{d}U + \mathrm{d}(p\,V) = \mathrm{d}U + p\,\mathrm{d}V + V\,\mathrm{d}p\end{equation}
D’après ce que l’on a écrit dans la deuxième expérience ci-dessus \begin{equation}\mathrm{d}H = \delta Q - p\,\mathrm{d}V + p\,\mathrm{d}V + V\,\mathrm{d}p = \delta Q\end{equation} puisque à pression constante $\mathrm{d}p =0$.
Finalement, dans le cas d’une transformation monobare, c’est à dire lorsque la pression du gaz à l’état initial et à l’état final est la même et égale à la pression extérieure (cas de nombreuses réactions chimiques qui sont même des transformations isobares, à pression extérieures constantes)
Enthalpie dans le cas d’une transformation monobare \begin{equation}\Delta H = Q\end{equation}
L’enthalpie est une fonction plus "intéressante" que l’énergie interne puisqu’elle tient compte de la façon dont a été stockée l’énergie apportée, celle-ci n’est pas nécessairement apportée que pour fournir de l’énergie interne au gaz, elle a pu servir aussi à augmenter le volume de celui-ci, comme on vient de le voir.
Deuxième loi de Joule
L’enthalpie d’un gaz parfait ne dépend que de la température.
\begin{equation}\boxed{\mathrm{d}H = C_p\,\mathrm{d}T}\end{equation}
Retour sur les capacités calorifiques
Avec les deux lois de Joule, on peut établir la relation entre la capacité calorifique à volume constant et la capacité calorifique à pression constante appelée relation de Mayer. En effet: \begin{equation}\begin{aligned} \mathrm{d}H &= \mathrm{d}U + \mathrm{d}(p\,V) \\ &= \mathrm{d}U + \mathrm{d}(n\,R\,T) \\ &= \mathrm{d}U + n\,R\,\mathrm{d}T \\ \Longleftrightarrow C_p\,\mathrm{d}T &= C_V\,\mathrm{d}T + n\,R\,\mathrm{d}T \\ \Longrightarrow C_p - C_V &= n\,R \end{aligned}\end{equation}
Relation de Mayer
Elle relie les capacités calorifiques à pression constante et à volume constant
\begin{equation}\boxed{C_p-C_V = n\,R}\end{equation}
On peut alors introduire ici un coefficient qui intervient souvent en thermodynamique qui est le rapport $\gamma = \dfrac{C_p}{C_V}$, appelé coefficient adiabatique ou coefficient de Laplace, on peut alors exprimer $C_p$ et $C_V$, en fonction de celui-ci grâce à la relation de Mayer puisque \begin{equation}\dfrac{C_p-C_V}{C_V} = \dfrac{n\,R}{C_V} \Longrightarrow \gamma -1 = \dfrac{n\,R}{C_V} \Longrightarrow C_V = \dfrac{n\,R}{\gamma-1}\end{equation} Et aussi \begin{equation}\dfrac{C_p-C_V}{C_p} = \dfrac{n\,R}{C_p} \Longrightarrow 1-\dfrac{1}{\gamma} = \dfrac{n\,R}{C_p} \Longrightarrow C_p = \dfrac{\gamma\,n\,R}{\gamma-1}\end{equation}
Coefficient adiabatique et expressions de $C_V$ et $C_p$
En posant \begin{equation}\gamma = \dfrac{C_p}{C_V}\end{equation} le coefficient adiabatique du gaz, on a \begin{equation}\boxed{C_V = \dfrac{n\,R}{\gamma-1}} \quad \text{et} \quad \boxed{C_p = \dfrac{\gamma\,n\,R}{\gamma-1}}\end{equation}
Ce chapitre est l'occasion de donner les définitions générales des capacités calorifiques à volume constant et à pression constante, en fonction de l'énergie interne et de l'enthalpie:
Définitions de $C_V$ et $C_p$
Pour les gaz réels: \begin{equation} C_V = \left(\dfrac{\partial U}{\partial T}\right)_V \quad \quad C_p = \left(\dfrac{\partial H}{\partial T}\right)_p \end{equation}Ressources :
- "Physique Tout-en-un MPSI PCSI PTSI" - Marie-Noëlle Sanz / Anne-Emmanuelle Badel / François Clausset - Editions Dunod 2008 ;
- https://videos.univ-grenoble-alpes.fr/la-formation/634-cours-de-thermodynamique-l/ ; cours de thermodynamique de Richard Taillet
- https://www.youtube.com/@physiqueprepa ; cours de thermodynamique de Nicolas Hergott
- https://www.lpp.polytechnique.fr/IMG/pdf/thermo.pdf
- http://demonstrations.wolfram.com/StatisticalNatureOfMaxwellBoltzmannDistribution/
- https://www.futura-sciences.com/sciences/definitions/physique-kelvin-353/