Suivi temporel d’une réaction chimique
Temps de demi réaction : le temps de demi réaction, noté , est atteint lorsque l’avancement de la réaction x est égal à la moitié de l’avancement maximal.
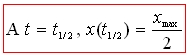
Vitesse volumique de réaction : on appelle vitesse volumique de réaction v(t) à l’instant t la dérivée par rapport au temps de l’avancement de la réaction x divisée par le volume du milieu réactionnel V. Elle s’exprime en mol.L-1.s-1 et a pour expression en phase homogène liquide :
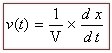
La vitesse d’une réaction est maximale à l’instant initial, décroît, puis s’annule lorsque la réaction arrive à son terme.
Rappelons que si on connaît la courbe x=f(t), on peut facilement commenter l’évolution de la vitesse car celle-ci est proportionnelle au coefficient directeur de la courbe x=f(t).
Utilisation de la conductimétrie :
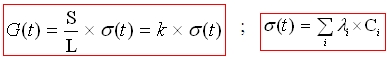
Attention !!! Les concentrations sont en mol.m-3
Utilisation de la spectrophotométrie :
Loi de Beer-Lambert : 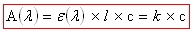
ε(λ) : coefficient d’extinction molaire de l’espèce absorbante
l : longueur de la cuve
c : concentration de la solution en mol/L
k : coefficient de proportionnalité entre A et c
Conditions d’application : lumière monochromatique, concentration pas trop grande, solution homogène.