Notion d’équilibre chimique : transformation totale ou limitée
Acide : espèce chimique capable de céder un ou plusieurs protons.
Base : espèce chimique capable de capter un ou plusieurs protons.
Réaction acido-basique : réaction dans laquelle l’acide d’un couple réagit avec la base d’un autre couple, et au cours de laquelle il y a échange de protons.
Le pH est lié à la concentration en ions H30+
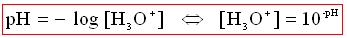
Certaines réactions chimiques ne sont pas totales. L’avancement maximal tel qu’il peut être calculé à l’aide du tableau d’avancement n’est jamais atteint. L’avancement d’une telle réaction tend vers une valeur limite appelée avancement final. On dit que le système a atteint un état d’équilibre lorsque l’avancement final est différent de l’avancement maximal.
Taux d’avancement : 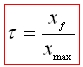
Lorsque t = 1, on peut dire que la réaction est totale, 100% des molécules se sont transformées. Autrement, la réaction est limitée.
Lorsque une transformation n’est pas totale, la réaction associée peut s’effectuer dans les deux sens, une telle réaction est dite réversible. L’équilibre atteint est un équilibre dynamique dans lequel les réactions inverses l’une de l’autre ont lieu simultanément et à la même vitesse.