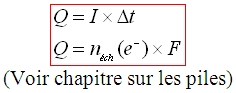Transformations forcées, électrolyses
Electrolyse : Une réaction qui se déroule dans le sens opposé à l’évolution spontanée est une évolution forcée. Elle est possible grâce à l’apport d’énergie. Cette réaction s’appelle électrolyse et s’arrête dès que l’on stoppe le générateur qui apporte l’énergie nécessaire.
Définitions :
- Lorsqu’un générateur de tension continue fournit de l’énergie électrique à un système chimique, il peut lui imposer d’évoluer dans le sens inverse de son sens d’évolution spontanée. La réaction s’arrête dès que l’on stoppe le générateur.
- Le courant imposé est inverse à celui qui serait observé lorsque le système évolue spontanément.
- Dans une électrolyse :
L’électrode reliée au pôle – du générateur électrique est le siège d’une réduction ; il s’agit de la cathode :
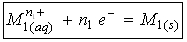 L’électrode reliée au pôle + du générateur électrique est le siège d’une oxydation ; il s’agit de l’anode :
L’électrode reliée au pôle + du générateur électrique est le siège d’une oxydation ; il s’agit de l’anode :
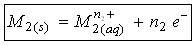
- Pour une transformation forcée, le quotient de réaction du système chimique s’éloigne de la constante d’équilibre.
Quantité d’électricité :