Agrégation/Capes > Capes : montages de chimie > capes-chimie-montage-2-aldehydes-cetones
CAPES-Montage chimie n°2 :
Expériences illustrant les propriétés chimiques des aldéhydes et des cétones
Pour rechercher un mot dans la page, utilisez la fonction de votre navigateur
(Ctrl + F)
Introduction :
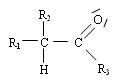
Les aldéhydes et les cétones font partis de la famille des dérivés carbonylés.
Si R3 = H, alors on a un aldéhyde ; si R3 = Cn, alors on a une cétone.
A l'état naturel, il s'agit souvent de molécules odorantes et ces molécules présentent souvent des cycles aromatiques. ex : le benzaldéhyde = essence d'amande amère.
Nous allons étudier leur différente réactivité.
Propriétés communes aux aldéhydes et aux cétones :
Addition nucléophile :
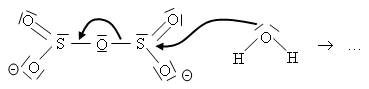
a. Combinaison bisulfitique :
A réaliser avec des gants
On prépare le réactif par la réaction dont l'équation et une partie du mécanisme sont écrits ci-dessous :
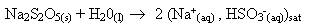
* Tube 1 :
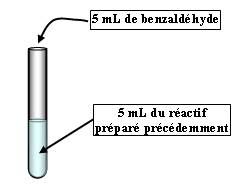
Observation : On obtient un précipité blanc.
* Réaction 1 :
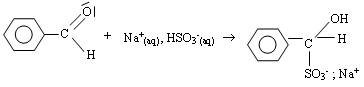
* Tube 2 :
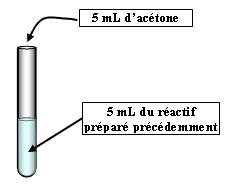
Observation : On a une formation plus lente de cristaux blanc. Si on refroidit dans la glace, on obtient le même précipité blanc que précédemment.
* Réaction 2 :
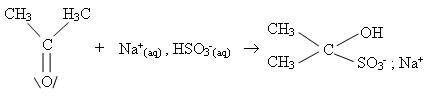
* Conclusion :
Le caractère électrophile étant plus marqué chez les aldéhydes que chez les cétones, la réaction est plus rapide avec ces aldéhydes.
On peut ainsi purifier les dérivés carbonylés dans un mélange.
b. Test à la 2,4 DNPH (condensation d'un amine) :
* Expérience :
A réaliser avec des gants et des lunettes. Manipuler l'éthanal sous hotte.
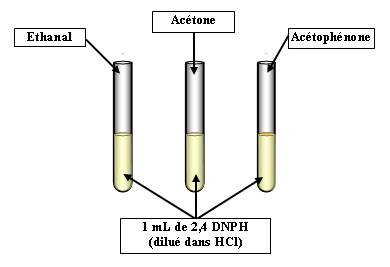
Observations : On obtient un précipité jaune avec l'éthanal et l'acétone, un précipité jaune-orangé avec l'acétophénone.
* Conclusion :
Le test a un intérêt qualitatif, selon la couleur du précipité, on peut en déduire la nature du dérivé :
Précipité jaune = dérivé haliphatique ; précipité jaune-orangé = dérivé aromatique.
Il a aussi un intérêt quantitatif, on peut sécher le précipité obtenu, et étudier son point de fusion.
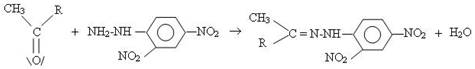
* Equation de la réaction :
Acidité des hydrogènes en alpha du carbonyle :
a. Aldolisation croisée :
Expérience :
A réaliser avec des gants pour le cinamaldéhyde.
La réaction sera faite pendant la préparation (agitation 15 min).
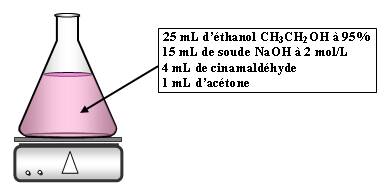
Observations :
On observe un trouble instantané de la solution de l'erlenmeyer et une formation de cristaux au bout de 15 minutes.
Suite de la manipulation :
On filtre la solution sur Büchner et on sèche à l'étuve le solide obtenu. On mesure alors la température de fusion sur banc Kofler : Tfus = 143°C (Tfus(théorique) = 144°C)
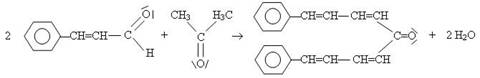
Equation de la réaction :
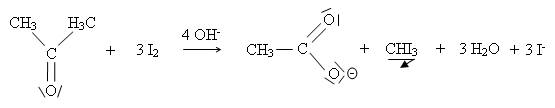
b. Test à l'iodoforme :
Expérience :

Observations :
Il y a formation d'un précipité jaune pâle.
Interprétations :
Il se produit l'oxydation de l'acétone en acide carboxylique correspondant
Ce test est caractéristique des cétones méthylées, de l'éthanal mais aussi de l'éthanol qui sera oxydé en éthanal par le diiode. On devra donc l'accompagner de tests complémentaires pour connaître la nature du réactif testé.
Equation de la réaction :
Remarque :
On peut filtrer le contenu du verre à pied pour récupérer le précipité et ainsi prendre son point de fusion au banc Kofler (Tfus = 119°C).
Propriétés différenciant les aldéhydes et les cétones :
oxydation :
a. Mise en évidence du caractère réducteur du glucose :
Expérience :
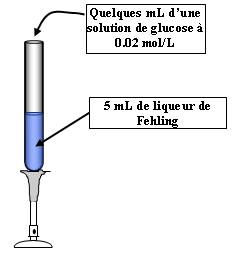
La liqueur de Fehling est une préparation contenant en même quantité du sulfate de cuivre CuSO4 et du tartrate de sodium.
Observation :
Lors du chauffage la solution du tube à essais passe du bleu au rouge.
Interprétation :
Il y a formation de Cu2O et oxydation du glucose en acide gluconique.
Equation de la réaction :
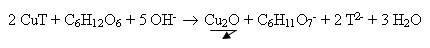
Les ions tartrates ont pour formule C4H4O62-.
b. Dosage des sucres dans l'isostar :
Manipulation préalable : à faire en préparation
On va hydrolyser l'isostar :
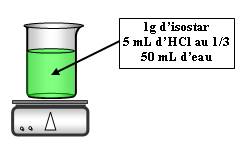
On chauffe pendant 20 minutes, on revient à un pH de 6-7 avec de la soude au tiers, puis on rajoute 200 mL d'eau.
Dosage par comparaison :
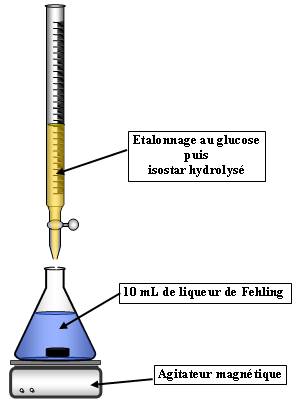
- En préparation on a étalonné la liqueur de Fehling avec une solution de glucose à 0.02 mol/L (on trouve Veq1 = 10 mL).
- On effectue alors le dosage avec l'isostar hydrolysé (on trouve Veq2)
- On obtient c = 2.04*10-2 mol/L (c = 0.02*(Veq1/Veq2))
- Ce qui fait 0.73 g de glucose dans 1 g d'isostar.
Fabrication d'une résine urée-méthanal :
A réaliser sous hotte avec des gants
Expérience :
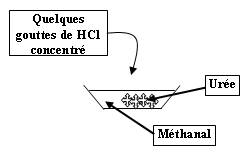
Observation :
Après quelques instants, on observe un début de cristallisation. On doit obtenir finalement une poudre blanche.
HCl joue le rôle de catalyseur.
Equation de la réaction :
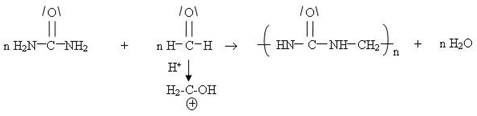
Remarque :
Cette résine est utiliser comme colle à bois ou dans la confection des panneaux de bois aggloméré.
Conclusion :
Ces composés sont utilisés en chimie industrielle. Parmi eux, le méthanal a un usage usuel en tant que désinfectant ou un conservateur.
L'éthanal quant à lui est un intermédiaire de synthèse.
L'acétone est un solvant de nombreuses laques et peintures.