Agrégation/Capes > Capes : montages de chimie > capes-chimie-montage-6-esterification-hydrolyse
CAPES-Montage chimie n°6 :
Expériences portant sur les réactions d'estérification et d'hydrolyse ainsi que sur la saponification des esters
Pour rechercher un mot dans la page, utilisez la fonction de votre navigateur
(Ctrl + F)
Introduction :
Les premières études ont été conduites par Berthelot au 19ème siècle.
La réaction d'estérification constitue un équilibre relativement lent comme l'hydrolyse qui est sa réaction inverse. Ces deux réactions se limitent donc l'une l'autre.
La saponification des esters quant à elle a un intérêt pratique, puisque c'est la réaction qui est à la base de la fabrication des savons et des lessives.
Etude de l'équilibre estérification-hydrolyse :
Mise en évidence de l'équilibre :
On étudie la réaction suivante :

On travaille avec différents mélanges :
- 0.1 mol d'acide + 0.1 mol d'alcool à température ambiante et sans catalyseur.
- 0.1 mol d'acide + 0.1 mol d'alcool sous chauffage à reflux (montage ci-dessus) et sans catalyseur.
- 0.1 mol d'acide + 0.1 mol d'alcool sous chauffage à reflux et avec quelques gouttes d'acide sulfurique (H2SO4.
- 0.1 mol d'eau + 0.1 mol d'ester sous chauffage à reflux et avec quelques gouttes d'acide sulfurique (H2SO4).
On fera chauffer les mélanges 2, 3 et 4 pendant 40 minutes environ.
Suite de l'étude des mélanges :
Après le temps de chauffage, on arrête les réactions des 4 mélanges en plongeant les ballons dans la glace.
Tout en conservant les mélanges dans la glace, on dosera alors l'acide restant (respectivement formé) à l'aide d'une solution d'hydroxyde de sodium et en présence de phénolphtaléine.
On effectue donc un dosage colorimétrique, l'équivalence étant repérée par persistance de la couleur rose dans le ballon.
Remarques :
Le dosage à froid de l'acide permet d'éviter un temps la saponification de l'ester ce qui consommerait des ions hydroxyde.
Mais si, une fois la persistance de la couleur rose obtenue, on laisse le mélange tel quel, la couleur disparaîtra du fait de cette réaction de saponification, qui même à froid se fait, très lentement.
Résultats :
- Pour le premier mélange :
Grâce au volume de soude versé à l'équivalence, on calcule le nombre de moles d'acide restant puis le nombre de moles d'acide consommé qui est aussi le nombre de moles d'ester formé (voir équation).
On peut alors en déduire le rendement :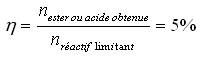
-
Pour le mélange n°2 :
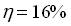
-
Pour ce mélange attention, une certaine quantité de soude va servir à doser le catalyseur (H2SO4). Ce volume a été évalué en préparation, il faut alors le soustraire au volume de soude versé à l'équivalence.
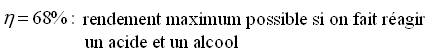
-
Pour ce dernier mélange, on va doser le nombre de moles d'acide créé.
Il faudra aussi soustraire le volume de soude nécessaire au dosage du
catalyseur (H2SO4).
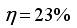
Facteurs influençant l'équilibre :
a. Elimination de l'eau du milieu réactionnel :
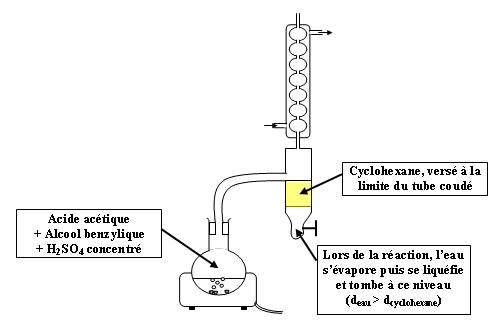
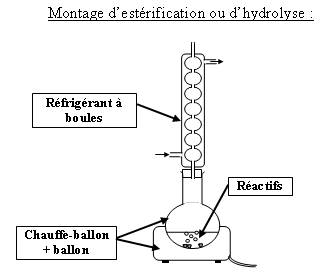
On va utiliser le montage de Dean-Stark :
Ce montage permet de récupérer l'eau formée après liquéfaction dans le réfrigérant.
Le but est d'éviter le contact entre l'ester formé et l'eau ce qui limite l'hydrolyse.
D'après l'équation de l'équilibre estérification-hydrolyse, on a nester = neau. On peut donc facilement calculer le rendement. Celui-ci doit augmenter par rapport au montage classique.
b. Utilisation d'un excès du réactif non limitant :
On va utiliser le réactif qui coûte le moins cher en fort excès, ce qui va avoir pour effet d'augmenter le rendement de l'estérification. Examinons le quotient de réaction à l'état d'équilibre :
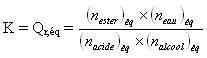
Imaginons que l'on se trouve à l'état d'équilibre,
alors si à ce moment, on rajoute une grande quantité d'alcool par
exemple, on modifie l'équilibre en faisant nettement baisser le
quotient de réaction (car nalcool se situe au dénominateur).
Le système va réagir, la réaction reprend (on forme de l'ester) pour
que le quotient de réaction soit de nouveau égal à la constante
d'équilibre.
On a formé plus d'ester, le rendement de la réactione est plus important.
Ce raisonnement est valable pour le paragraphe précédent, c'est à dire lorsque l'on enlève l'eau du milieu réactionnel.
c. Utilisation d'un composé plus réactif :
Pour réaliser une estérification totale, il suffit de changer un des réactifs.
On peut utiliser dans ce sens un anhydride d'acide ou un chlorure d'acyle.
Remarque :
On sait caractériser la présence d'un ester à l'aide du test hydroxamique.
Réaction de saponification :
Montage :
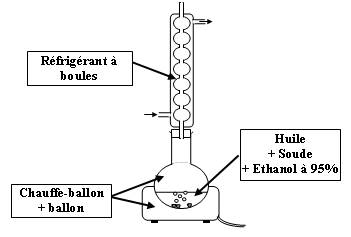
En latin, le mot saponification signifie "faire du savon".
Cette réaction est totale et relativement lente. A température ambiante, il faut environ un an pour que la réaction est lieue.
On va donc chauffer ici à reflux pendant 30 minutes.
Relargage et filtration :
A la fin du chauffage, on verse le contenu du ballon dans une solution de NaCl saturée, c'est l'opération de relargage.
Celle-ci permet de faire précipiter le savon étant donné que ce dernier est pratiquement insoluble dans l'eau salée.
Il suffit alors de filtrer sur Büchner pour récupérer le savon.
Conclusion :
Ces deux réactions d'estérification et de saponification sont très importantes car elles permettent de synthétiser deux produits d'usage courant.
En effet, la saponification est la réaction de base pour la préparation des savons et des lessives ;
l'estérification quant à elle, permet de synthétiser les esters qui sont les principaux produits de base de l'industrie des parfums.