Agrégation/Capes > Capes : montages de chimie > capes-chimie-montage-5-addition-substitution
CAPES-Montage chimie n°5 :
Expériences portant sur les réactions d'addition et de substitution en chimie organique
Pour rechercher un mot dans la page, utilisez la fonction de votre navigateur
(Ctrl + F)
Introduction :
En chimie organique, on distingue généralement 4 types de réaction : les additions, les substitutions, les éliminations et les transpositions.
Nous n'en exposerons que deux ici par simplification expérimentale.
Ces réactions peuvent conduire à des produits d'usage courant : Plexiglas, polystyrène, ...
Les réactions d'addition :
Addition électrophile : détermination de l'indice d'une huile :
L'huile est un composé très insaturé (nombreuses doubles liaisons).
On va évaluer le nombre d'insaturations, en mesurant la quantité d'iode qui s'ajoute à l'huile (à la place des insaturations) :
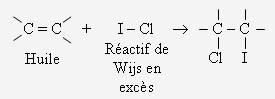
Expérience :

- On laisse agir 40 minutes dans l'obscurité.
- On traite par 100 mL d'eau et 10 mL d'iodure de potassium K
(I-Cl + K--> I2 + K+ + Cl-). - On laisse agir et on dose l'excès de diiode I2 par le thiosulfate de sodium Na2SO3.
Indice d'huile :
Masse de I2 pour 100g d'huile :
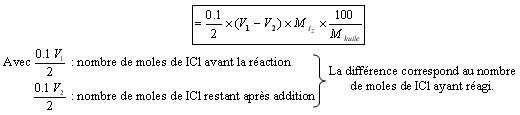
Le dosage du témoin fait en préparation donne le volume V1.
Le dosage de la vraie réaction donne le volume V2.
L'équivalence des dosages au thiosulfate de sodium est repérée par la décoloration de la solution.
Ithéorique = 80-100
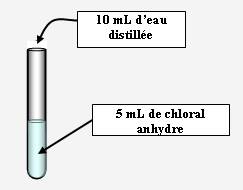
Addition hétérolytique nucléophile : hydratation du chloral anhydre :
Expérience :
A réaliser sous hotte avec des gants et des lunettes
Observations :
Après agitation, il y a formation d'une mousse puis d'un solide (la réaction aura été faite en préparation).
Interprétation :
Ce solide obtenu est le chloral hydraté qui est un narcotique, un hypnotique et un sédatif.
Equation de la réaction :
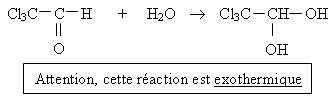
Remarques :
Un narcotique est un produit qui provoque le sommeil.
Un sédatif agit contre la douleur, l'anxiété et l'insomnie. Il modère également l'activité d'un organe.
Addition homolytique radicalaire : formation du Plexiglas :
Expérience :
A réaliser avec des gants
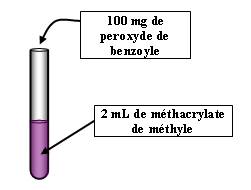
On met le produit dans un bain marie à 80-90°C (Il faudra lancer cette manipulation en premier, c'est à dire au début de la présentation).
Observation :
Il y a création d'une masse transparente. Le Plexiglas sert à remplacer le verre car contrairement à celui-ci, il est pratiquement incassable.
Réaction :
Celle-ci est une polyaddition qui donne à partir du monomère, le métacrylate de méthyle, le polymère plexiglas dont le motif est donné ci-dessous :
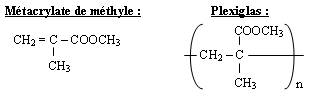
Les réactions de substitution :
Substitution nucléophile : SN1 et SN2 :
Ces deux expériences sont à réaliser avec des gants
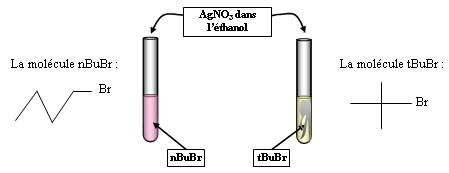
Expérience 1 :
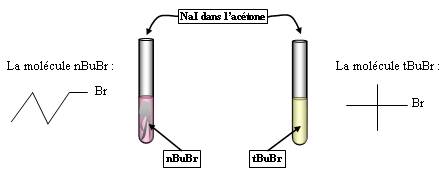
Observations :
Le premier tube donne un précipité, pas le deuxième.
Interprétation :
Solvant aprotique (acétone) + dérivé primaire (nBuBr) = SN2
Equation de la réaction :
Na+ nBuBr  nBu+ NaBr
nBu+ NaBr
Expérience 2 :
Observations :
Le deuxième tube donne un précipité, pas le premier.
Interprétation :
Solvant protique polaire (éthanol) + dérivé tertiaire (tBuBr) = SN1
Equation de la réaction :
Ag+ + NO3- + tBuBr  AgBr + tBuOC2H5 + HNO3
AgBr + tBuOC2H5 + HNO3
Remarques :
Solvant protique :
Un solvant est protique lorsqu'il est capable de libérer un ou plusieurs protons H+ (protons labiles : qui peuvent être libérés). Ils peuvent donner des liaisons hydrogènes. Ex : eau, alcools (ceux-ci sont aussi polaires).
Solvant polaire :
Un solvant est polaire s'il possède un moment dipolaire non nul (il y a disymétrie des charges électriques dans la molécule). Ex : acétone, DMSO : (CH3)2SO (aprotiques).
Substitution électrophile : acylation du toluène :
Expérience :
A réaliser avec des gants et sous la hotte
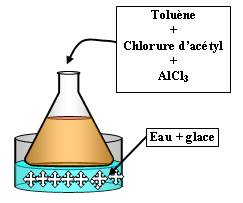
Il faut verser très délicatement le chlorure d'acétyle car la réaction est très exothermique.
On est en présence du réaction de Friedel et Crafts.
Manipulations complémentaires :
Dans une ampoule à décanter, on mélange le contenu de l'erlenmeyer et de l'eau distillée. On observe alors la formation de deux phases.
On récupère la phase organique et on la teste à la 2,4 DNPH.
On obtient ainsi un précipité jaune-orangée caractéristique des dérivés carbonylés.
Equation de la réaction :
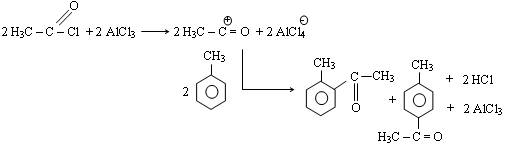
Remarque : Réaction de Friedel et Crafts
C'est une réaction qui permet d'ajouter des chaînes latérales (alkyl (groupement -R) ou alcyl (groupement -RCO)) à des cycles aromatiques. Ceci se fait par l'intermédiaire de composés organiques chlorés (R-Cl ou R-CO-Cl).
Le catalyseur de ces réactions est un acide de Lewis (possédant une lacune électronique) tel que AlCl3.
Réaction de polycondensation : synthèse du nylon 6-10
A réaliser sous hotte
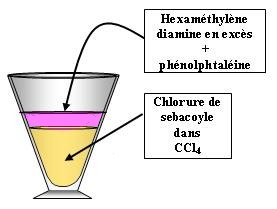
- En premier, on verse le chlorure de sebacoyle car il est le réactif le plus dense.
- Ensuite, on verse l'hexaméthyle diamine.
- Enfin, on rajoute quelques gouttes de phénolphtaléine pour l'observation.
- On peut tirer une fibre de nylon avec un agitateur.
Observations :
A l'interface des deux composés se créé un film que l'on peut étirer à l'aide d'un crochet (film = nylon).
La réaction stoppera une fois qu'il manquera un des deux réactifs.
Equation de la réaction :
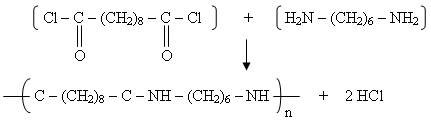
Conclusion :
Tous ces mécanismes sont fréquents dans la synthèse de produits industriels comme le montrent ici les réactions proposées (fabrication de narcotique, plexiglas, nylon, ...).