Questionnaire TS-Chimie-chap 5 :
Transformations totales ou limitées
Rappels : les réactions acido-basiques
- Donnez la définition d'un acide selon Bronsted et rappelez à quelle demi-équation acidobasique il répond :
- Donnez la définition d'une base selon Bronsted et rappelez à quelle demi-équation acidobasique il répond :
- Comment appelle-t-on l'ensemble d'un acide et d'une base liés par une demi-équation acidobasique ? Quelle notation utilisons-nous pour cet ensemble ?
- Complétez : Dans l'équation HA = A- + H+, on dit que HA est l'............ ................. de A- et que A- est la ........ ................. de HA.
- Donnez la définition d'une équation acidobasique :
- Ecrivez la réaction acide-base qui s'effectue entre l'acide éthanoïque (CH3COOH) et les ions hydroxyde OH- (vous commençerez par donner les demi-équations acidobasiques de chaque couple, dans le sens approprié) :
Le pH et sa mesure :
- Donnez la formule de calcul du pH pour des solutions aqueuses diluées :
- Donnez la formule inverse permettant de calculer la concentration en ion oxonium en fonction du pH :
- On sait que la fonction logarythme est une fonction croissante :
quel est lien entre la variation du pH et la variation de la concentration en ions oxonium ? - Donnez deux méthodes permettant de mesure le pH et décrivez-les sommairement ?
Réaction totale ou limitée :
1ER cas : mise en solution du chlorure d'hydrogène dans l'eau :
Lorsque l'on veut une solution aqueuse d'acide chlorhydrique, on dissous le gaz chlorure d'hydrogène (soluté) dans de l'eau (solvant).
- Ecrivez l'équation de mise en solution du chlorure d'hydrogène dans l'eau :
On considère une solution d'acide chlorhydrique de concentration c = 1.0*10-2 mol/L.
On mesure le pH d'un volume V de solution, on obtient alors pH = 2.0.
Complétez littéralement (qu'avec des lettres) le tableau d'avancement ci-dessous :
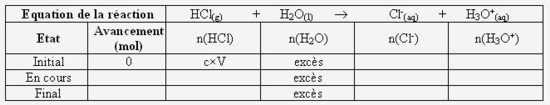
- Calculez la concentration et la quantité de matière en ions oxonium à la fin de la réaction. Concluez quand au caractère total de cette réaction :
- Définissez le taux d'avancement d'une transformation chimique et calculez-le dans le cas présent :
2EME cas : mise en solution de l'acide éthanoïque pur dans l'eau :
Lorsque l'on veut une solution aqueuse d'acide éthanoïque, on dissous de l'acide éthanoïque pur (soluté) dans de l'eau (solvant).
- Ecrivez l'équation de mise en solution de l'acide éthanoïque pur dans l'eau :
On considère une solution d'acide éthanoïque de concentration c = 1.0*10-2 mol/L.
On mesure le pH d'un volume V de solution, on obtient alors pH = 3.4.
- Complétez littéralement (qu'avec des lettres) le tableau d'avancement ci-dessous :
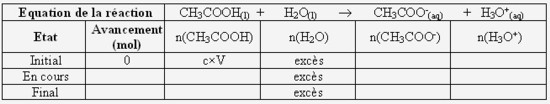
- Calculez la concentration et la quantité de matière en ions oxonium à la fin de la réaction. Concluez quand au caractère total de cette réaction :
- Calculez le taux d'avancement de cette transformation chimique :
Sachant que la réaction est très limitée, nous utiliserons comme formalisme d'écriture entre les réactifs et les produits non plus une simple flèche mais un signe égal.
Notion d'équilibre : la réaction s'effectue dans les deux sens :
- Calculez les diverses concentrations des espèces chimiques présentes en fin de réaction dans le cas de la dissociation de l'acide éthanoïque pur :
- Quel est le seul paramètre dont dépende ces concentrations ? comment varie ce paramètre donc les concentrations calculées ci-dessus ?
- En considérant des aspects microscopiques, essayez d'expliquer pourquoi on parle d'équilibre dynamique lorsque l'on considère une réaction limitée du type A + B = C + D :