TS-Chimie-chap 5 :
Transformations totales ou limitées
Pour rechercher un mot dans la page, utilisez la fonction de votre navigateur
(Ctrl + F)
Rappels : les réactions acido-basiques
- Donnez la définition d'un acide selon Bronsted et rappelez à quelle demi-équation acidobasique il répond :
Selon Bronsted, un acide (HA) est une espèce chimique susceptible de céder un proton selon l'équation : HA = A- + H+.
- Donnez la définition d'une base selon Bronsted et rappelez à quelle demi-équation acidobasique il répond :
Selon Bronsted, une base (A-) est une espèce chimique susceptible d'accepter un proton selon l'équation : A- + H+ = HA .
- Comment appelle-t-on l'ensemble d'un acide et d'une base liés par une demi-équation acidobasique ? Quelle notation utilisons-nous pour cet ensemble ?
Un acide et une base liés par une demi-équation acidobasique forment un couple acidobasique que l'on note HA/A-.
- Complétez :Dans l'équation HA = A- + H+, on dit que HA est l'acide conjugué de A- et que A- est la base conjuguée de HA.
- Donnez la définition d'une équation acidobasique :
Une réaction acidobasique met en jeu un transfert de proton entre l'acide d'un couple acidobasique et la base d'un autre couple acidobasique.
- Ecrivez la réaction acide-base qui s'effectue entre l'acide éthanoïque (CH3COOH) et les ions hydroxyde OH- (vous commençerez par donner les demi-équations acidobasiques de chaque couple, dans le sens approprié) :
L'acide éthanoïque appartient au couple acidobasique CH3COOH / CH3COO- : CH3COOH = CH3COO- + H+
Les ions hydroxyde appartiennent au couple acidobasique H2O / OH- :
OH- + H+ = H2O
En ajoutant membre à membre les deux demi-équations acidobasiques ci-dessus, on obtient :
CH3COOH + OH- = CH3COO- + H2O
Le pH et sa mesure :
- Donnez la formule de calcul du pH pour des solutions aqueuses diluées :
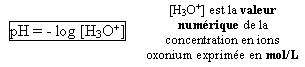
- Donnez la formule inverse permettant de calculer la concentration en ion oxonium en fonction du pH :
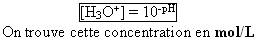
- On sait que la fonction logarythme est une fonction croissante :
quel est lien entre la variation du pH et la variation de la concentration en ions oxonium ?Si le pH est grand, la solution est peu acide, la concentration en ions oxonium est faible.
Si le pH est petit, la solution est très acide, la concentration en ions oxonium est grande. - Donnez deux méthodes permettant de mesure le pH et décrivez-les sommairement ?
- On peut utiliser le papier pH :
on met en contact une goutte de solution à tester avec un bout de papier pH, selon la couleur qu'il prend (on compare avec un nuancier présent sur l'emballage du papier), on pourra connaître le pH à l'unité près. - Pour davantage de précision, on utilisera un pH-mètre :
on plonge une électrode combinée (contenant une électrode de verre et une électrode de référence) dans la solution à tester, le pH-mètre mesure la différence de potentiel entre les deux électrodes (de l'électrode combinée) et "traduit" cette tension en valeur de pH.
On obtient une précision au dixième de degré pH près.
- On peut utiliser le papier pH :
Réaction totale ou limitée :
1ER cas : mise en solution du chlorure d'hydrogène dans l'eau :
Lorsque l'on veut une solution aqueuse d'acide chlorhydrique, on dissous le gaz chlorure d'hydrogène (soluté) dans de l'eau (solvant).
- Ecrivez l'équation de mise en solution du chlorure d'hydrogène dans l'eau :
HCl(g) + H2O(l) → Cl-(aq) + H3O+(aq)
On considère une solution d'acide chlorhydrique de concentration c = 1.0*10-2 mol/L.
On mesure le pH d'un volume V de solution, on obtient alors pH = 2.0.
Complétez littéralement (qu'avec des lettres) le tableau d'avancement ci-dessous :
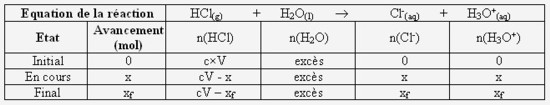
- Calculez la concentration et la quantité de matière en ions oxonium à la fin de la réaction. Concluez quand au caractère total de cette réaction :
On a [H3O+] = 10-pH = 1.0*10-2 mol/L d'où x(H3O+) = xf = 1.0*10-2 * V = c*V
Ainsi, le chlorure d'hydrogène introduit est totalement dissocié, l'avancement maximal est atteint et la réaction est totale. - Définissez le taux d'avancement d'une transformation chimique et calculez-le dans le cas présent :
Littéralement, le taux d'avancement est le rapport entre l'avancement de la réaction à l'état d'équilibre (avancement réel) et l'avancement maximal de la réaction (celui que l'on pourrait avoir si la réaction était totale).
Ainsi : τ = xf / xmax
Pour le cas de la dissociation du chlorure d'hydrogène dans l'eau :
τ = ([H3O+] * V) / (c * V) = [H3O+] / c = 1
Le taux d'avancement est de 100% ici (100% des molécules de chlorure d'hydrogène ont été dissociées) puisque la réaction est totale.
2EME cas : mise en solution de l'acide éthanoïque pur dans l'eau :
Lorsque l'on veut une solution aqueuse d'acide éthanoïque, on dissous de l'acide éthanoïque pur (soluté) dans de l'eau (solvant).
- Ecrivez l'équation de mise en solution de l'acide éthanoïque pur dans l'eau :
CH3COOH(l) + H2O(l) → CH3COO-(aq) + H3O+(aq)
On considère une solution d'acide éthanoïque de concentration c = 1.0*10-2 mol/L.
On mesure le pH d'un volume V de solution, on obtient alors pH = 3.4.
Complétez littéralement (qu'avec des lettres) le tableau d'avancement ci-dessous :
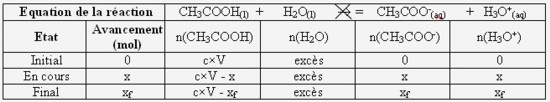
- Calculez la concentration et la quantité de matière en ions oxonium à la fin de la réaction. Concluez quand au caractère total de cette réaction :
On a [H3O+] = 10-pH = 4.0*10-4 mol/L d'où x(H3O+) = xf = 4.0*10-4 * V << c*V
Ainsi, il reste une grande quantité de molécules d'acide éthanoïque pur qui n'ont pas été dissociées, la réaction n'est pas totale et dite limitée, l'avancement maximal n'ayant pas été atteint. - Calculez le taux d'avancement de cette transformation chimique :
τ = xf / xmax = ([H3O+] * V) / (c * V) = [H3O+] / c = 4.0*10-4 / 1.0*10-2 = 0.04
Le taux d'avancement est de 4% ici (4% des molécules d'acide éthanoïque pur ont été dissociées), la réaction est très limitée.
Sachant que la réaction est très limitée, nous utiliserons comme formalisme d'écriture entre les réactifs et les produits non plus une simple flèche mais un signe égal.
Notion d'équilibre : la réaction s'effectue dans les deux sens :
- Calculez les diverses concentrations des espèces chimiques présentes en fin de réaction dans le cas de la dissociation de l'acide éthanoïque pur :
Nous avons déjà calculé [H3O+] = [CH3COO-] = 4.0*10-4 mol/L
Nous pouvons calculer [CH3COOH] d'après le tableau d'avancement :
[CH3COOH] = (c*V - xf) / V = c - [H3O+] = 1.0*10-2 - 4.0*10-4 = 9.6*10-3 mol/L - Quel est le seul paramètre dont dépende ces concentrations ? comment varie ce paramètre donc les concentrations calculées ci-dessus ?
Les concentrations sont calculées à l'aide de la donnée de pH. Celui-ci est constant donc les concentrations sont constantes.
La transformation est à l'équilibre. - En considérant des aspects microscopiques, essayez d'expliquer pourquoi on parle d'équilibre dynamique lorsque l'on considère une réaction limitée du type A + B = C + D
Imaginons qu'au départ, on met A et B en présence. Grâce à l'agitation thermique, il se produit des chocs efficaces entre A et B qui vont créer les molécules C et D.
Il est donc tout à fait probable que, toujours sous l'effet de l'agitation thermique, C et D se rencontrent pour donner A et B.
Comme au départ, A et B sont en grande quantité par rapport à C et D, la réaction qui forme C et D est privilégiée.
Mais à un moment donné, les deux réactions inverses A+B = C+D et C+D = A+B se feront à la même vitesse de sorte que l'on aura autant d'espèces formées que d'espèces consommées pour A, B, C et D.
A cet instant, on aura atteint l'état d'équilibre, équilibre dynamique car les deux réactions continuent de se faire à la même vitesse (macroscopiquement, on ne voit rien de changer).